类风湿性关节炎(rheumatoid arthritis,RA)是世界性顽固疾病,但衰老是否为影响疾病的危险因素和机制尚不清楚。
近年来,从基因调控入手,研究RA的精准发病机制以及防治靶点是国际风湿免疫领域的研究热点。西南医科大学附属医院罗未聃博士最新研究发现:老年人及老年RA患者中,TREX1基因表达较年轻人或健康老年人明显降低,且血清cfDNA升高,这提示机体cfDNA水平与年龄以及RA的发病机制相关联。基于这一新发现,研究团队设计了一系列关节炎动物实验予以验证。
7月20日,西南医科大学附属医院罗未聃博士以第一作者在Nature Communications发表题为《Age-related self-DNA accumulation may accelerate arthritis in rats and in human rheumatoid arthritis》的研究论文(2023年影响因子:16.6; DOI : 10.1038/s41467-023-40113-3),澳科大重点实验室黄锦伟教授为通讯作者,西南医科大学附属医院为第二单位。(西南医科大学附属医院血管外科主任刘勇教授为第四作者)
据悉,罗未聃医生是西南医科大学附属医院送培澳门博士中第一位发表Nature Communications的博士;是澳门科技大学国家重点实验室第二位以博士研究生身份发表Nature Communications的学生;也是西南医科大学附属医院第一位在Nature Communications发表论著的青年医生。
他都研究了什么?
得出了什么结论?
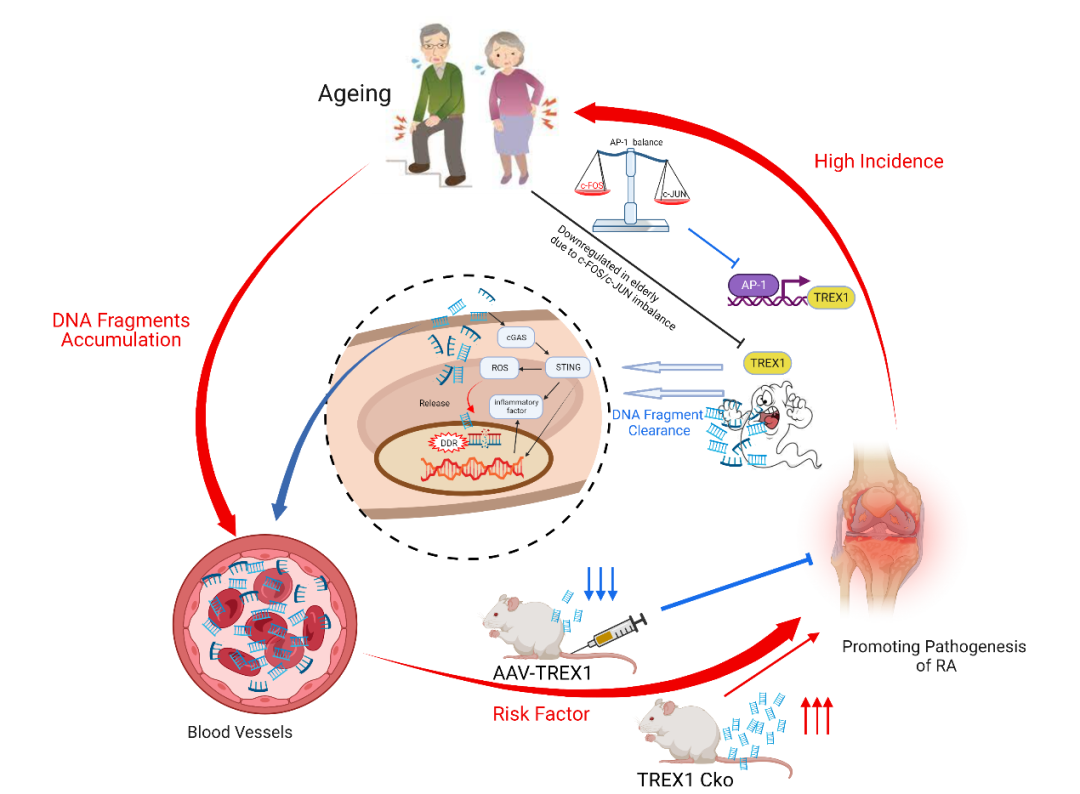
在研究中,AIA模型中循环DNA碎片的积累被证实是由TREX1表达减少触发的,最终促进了促炎细胞因子的释放并在AIA大鼠中产生炎症状况。
通过Cre-LoxP系统在条件敲除大鼠中进行验证,目前的研究表明,敲低3'->5'DNA核酸外切酶TREX1会增加AIA大鼠关节炎的严重程度。相比之下,腺相关病毒(AAV)转导对TREX1的过表达显著抑制了AIA大鼠衰老相关分泌表型(SASP)并抑制了关节炎炎症。
进一步的机制研究表明,衰老细胞中c-Jun和c-Fos比例失衡形成的异二聚体AP-1(TREX1的主要转录因子),导致TREX1转录水平下降,伴随着对DNA片段刺激的敏感性降低,从而可能导致炎症启动延长(图1)。
研究结果强调,由于TREX1减少而导致的DNA片段积累可能是老年人RA发病机制的危险因素之一。这为研发预防老年人患RA的靶向新药开辟了新思路,揭示了类风关发病的新机制,开启了启动TREX1基因或增强cfDNA代谢预防及治疗老年RA的新策略。
